NIBIB investigadores han creado un nanovaccine que podría hacer un enfoque actual para la inmunoterapia del cáncer más eficaz y al mismo tiempo reducir los efectos secundarios. El nanovaccine ayuda a entregar de manera eficiente una secuencia de ADN única para las células inmunes - una secuencia derivada de ADN bacteriano y se utiliza para desencadenar una reacción inmune. El nanovaccine también protege al ADN de la destrucción en el interior del cuerpo, donde las enzimas de corte de ADN son penetrantes, así como fuera del cuerpo cuando se expone a temperaturas cálidas, mientras que de ser almacenado o transportado. Los investigadores han probado con éxito el nanovaccine en ratones y detallado de su trabajo en la edición de marzo 2016 de la revista nanoescala.
Los tumores evadir al sistema inmune mediante la supresión de su capacidad para reconocer y destruir las células cancerosas. El objetivo de la inmunoterapia es normalizar y aprovechar el sistema inmunológico del cuerpo para que se pueda luchar con mayor eficacia los tumores.
Un enfoque para la inmunoterapia ha sido introducir una sustancia extraña en el cuerpo llamado oligodesoxinucleótidos citosina-guanina no metilados (CpG) o. CpG son distintos patrones de secuencias de ADN que se producen en las bacterias, pero son raras en los mamíferos. Cuando se inyecta en los seres humanos, los CpG actúan como una señal de peligro que desencadena una respuesta inmune.Recientemente, un número de ensayos clínicos han experimentado con la inyección de CpG directamente en un tumor como una manera de activar las células inmunes en las inmediaciones de modo que atacan.
Además de inducir una respuesta inmune en el sitio del tumor, también se cree CpG para estimular las células inmunes responsables de la iniciación de la respuesta inmune adaptativa sistémica del cuerpo.Esto puede ayudar al sistema inmune recuerde proteínas específicas asociadas con las células de cáncer de manera que pueda identificar y destruir las células de cáncer si se propagan.
Sin embargo, a pesar de su potencial, la inmunoterapia basada en CpG se ha visto obstaculizada por una serie de desafíos. Lo más notable es que CpG no pasa mucho tiempo dentro de un tumor, una vez inyectado en ella. Esto se debe a que los CpG son moléculas relativamente pequeñas y tienen una carga negativa, dos características principales que las causan que sean eliminadas rápidamente por el cuerpo.CpG también son susceptibles a la degradación por enzimas de ADN-orientación. Como resultado, no son a menudo suficientes CpG disponibles para estimular las células inmunes para generar una respuesta inmune suficiente.
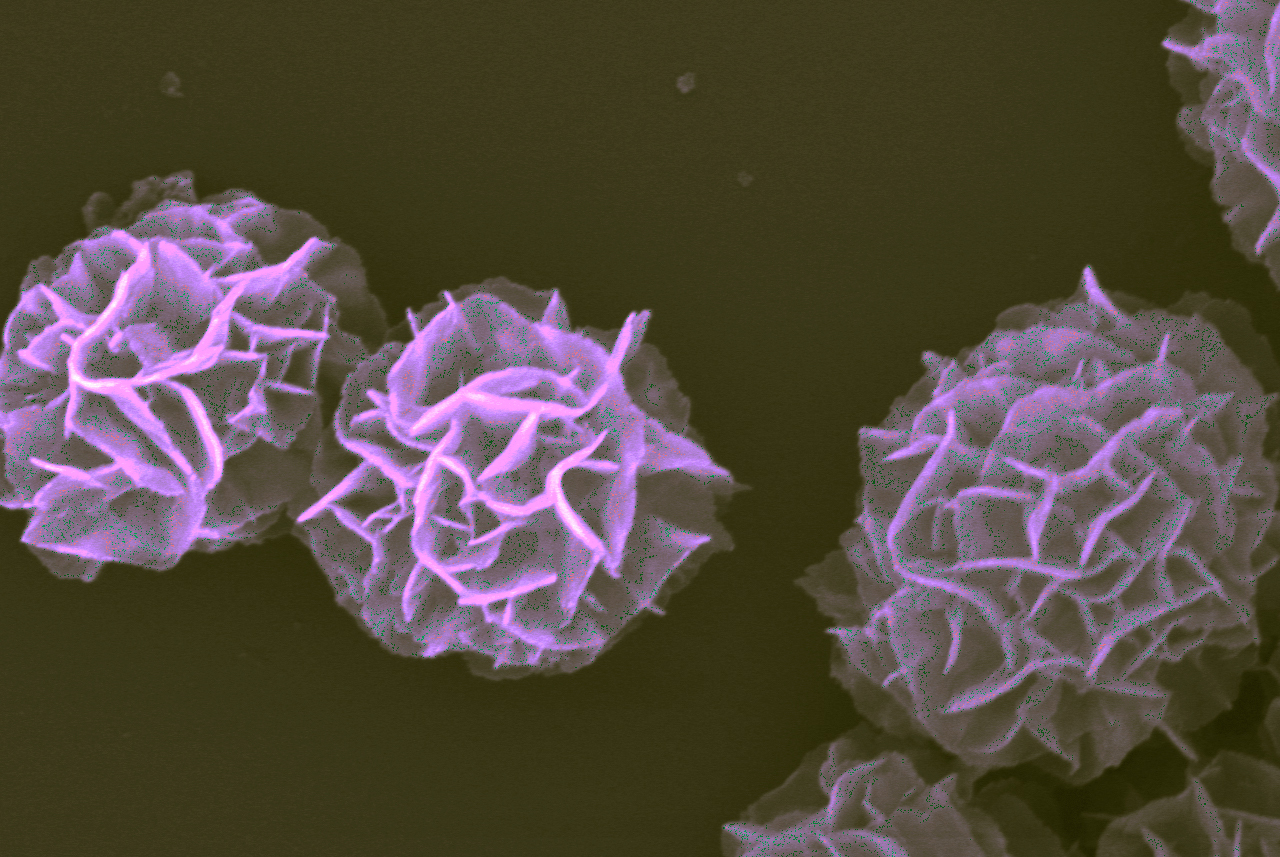
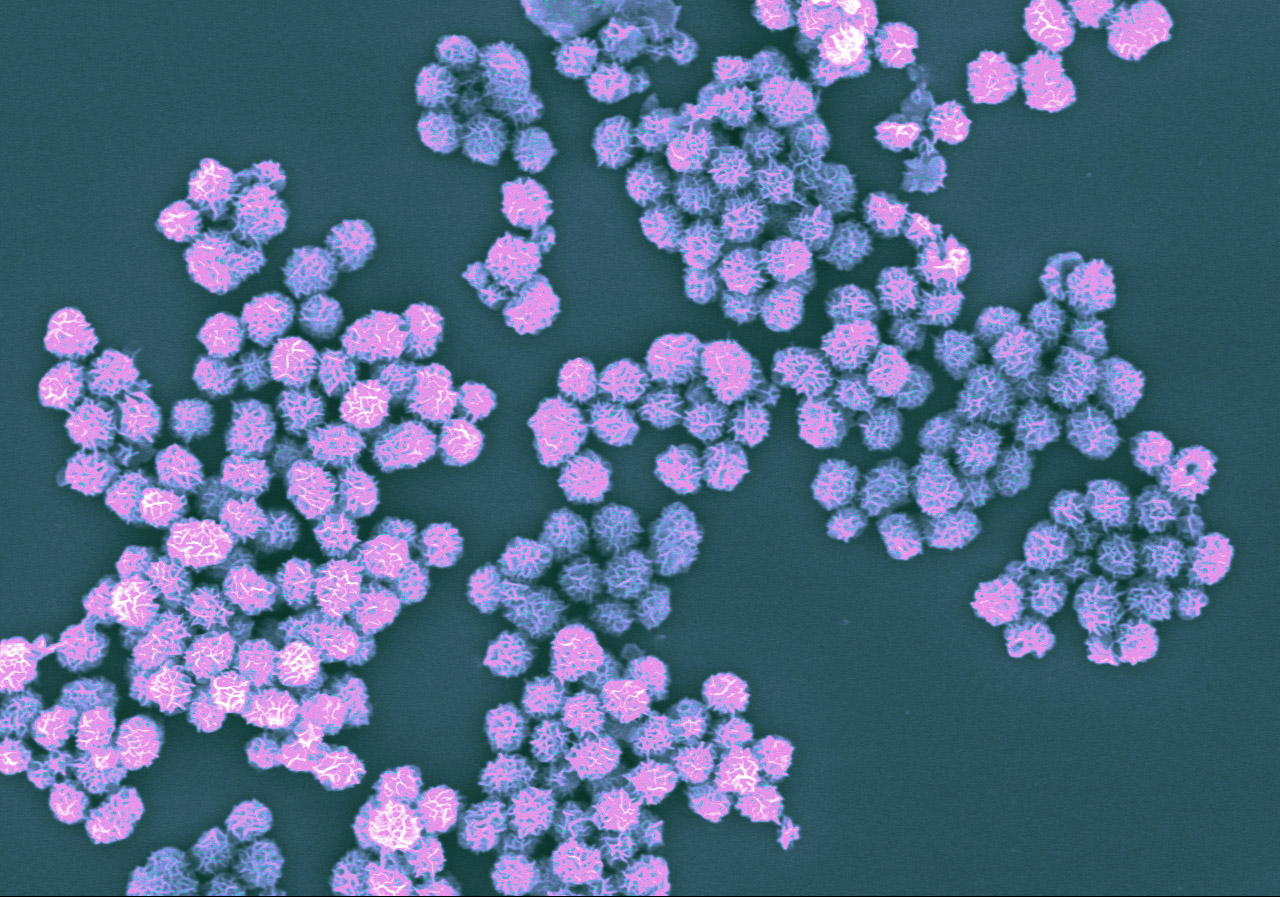
Imagen ampliada de complejos nanovaccine que muestran la estructura como una flor. Cada complejo es de aproximadamente una micra de diámetro, que es equivalente a 1/100 del grosor de un cabello humano. Imagen tomada con un microscopio electrónico de barrido y de color púrpura.
Para determinar el comportamiento de hNVs en células de ratón inmune, los investigadores incorporar moléculas fluorescentes en ellos de modo que pudieran ser visualizados. Ellos encontraron que los hNVs se tomaron de manera eficiente por dos tipos diferentes de células del sistema inmune del ratón, y se indujo la activación de las células inmunes como se evidencia por su secreción de las proteínas implicadas en la inflamación.
A continuación, en ratones que habían sido dados melanoma, los investigadores inyectaron o bien hNVs o sólo las moléculas de CpG solo. El hNVs permanecido en el ambiente del tumor más largo que las moléculas de CpG, y después de dos inyecciones espaciadas seis días de diferencia, los hNVs tenido un mayor efecto inhibitorio sobre el crecimiento de tumores de los ratones. Como resultado, dos de los cinco ratones que recibieron hNVs todavía estaban vivos después de 37 días de tratamiento (momento en el cual el estudio terminado), mientras que no hay ratones que recibieron CpG solo sobrevivieron pasado día 30.
Además de aumentar la respuesta inmune inducida por CpG, los hNVs también reducen los efectos secundarios asociados con la administración de CpG por la disminución de la cantidad de CpG que se filtró del tumor y en el torrente sanguíneo. Una indicación de los efectos secundarios de la inmunoterapia CpG es un agrandamiento del bazo. Los investigadores demostraron que los ratones inyectados con hNVs tenían bazos que pesaban casi la mitad que los ratones inyectados con las moléculas de CpG.
Según los investigadores, un beneficio adicional de la hNVs es que estabilizan las GPC de manera que no necesitan ser refrigerados almacenados o transportados. Esto es importante porque los requisitos de refrigeración pueden aumentar significativamente el precio de las vacunas y limitar quién tiene acceso a ellos.
"Lo que es interesante acerca de estos complejos nanovaccine es que son fáciles de hacer, sin embargo, tienen muchas capacidades", dijo Zhu Guizhi, Ph.D., autor principal del artículo. "Permiten un gran número de moléculas de CpG para ser entregados a las células inmunes, que impiden el escape de CpG en el torrente sanguíneo y, al hacerlo, reducir los efectos secundarios; que pueden acomodar moléculas fluorescentes de modo que el comportamiento de CpG puede ser estudiado, y permiten CpG que se almacena en condiciones no refrigeradas. "
En el futuro, los investigadores planean investigar los efectos de combinar los hNVs con antígenos específicos de tumores, que son proteínas que se encuentran sólo en las células tumorales. Mediante la adición de estas proteínas, que esperan para instruir aún más el sistema inmunológico en cuanto a que las células son cancerosas y deben ser sacrificados. También están interesados en la combinación de los hNVs con quimioterapia, así como la radiación terapia. Nanovaccine híbrido DNA-inorgánico para la inmunoterapia del cáncer.
ADN-inorgánicos nanovaccine híbrido para la inmunoterapia del cáncer . Zhu G, Liu Y, Yang X, Kim YH, Huimin Zhang H, Jia R, Liao SA, Jin A, Lin J, Aronova M, Leapman R, Nie Z, Niu G y Chen X. nanoescala.2016 28 de Mar.
Condiciones de salud:
Cáncer,
Administración de fármacos,
Terapéutico
No hay comentarios:
Publicar un comentario